
Спирометрия при муковисцидозе
От клинической к лекарственно-индуцированной бронхиальной обструкции
Основной молекулярный дефект при муковисцидозе (МВ) приводит к обезвоживанию перицилиарной жидкости в респираторном эпителии. Это постепенно приводит к эндолюминальному застою инфицированных выделений, воспалению, анатомическому повреждению и функциональной потере, ведущей к отказу органа. Функциональные повреждения развиваются с течением времени и могут быть изучены с помощью нескольких тестов дыхательной функции, каждый из которых предназначен для различных стадий развития заболевания. Однако этоГІ ГІ возможно только в оборудованной лаборатории патофизиологии дыхания.
В повседневной клинической практике и в различных территориальных реалиях, однако, необходимо иметь простые, надежные и, возможно, недорогие инструменты, которые позволяют достаточно достоверно оценить функцию легких. Наиболее часто используемым тестом является спирометрия, которая чрезвычайно полезна для клинической оценки состояния пациентов с МВ. Однако важно знать об ограничениях этого теста, чтобы правильно интерпретировать информацию, которую он предоставляет.
Преимущества и ограничения спирометрии
Проведение спирометрических исследований с самого детства способствует получению правильной клинической картины пациента и оценке его прогресса с течением времени, как путем выявления эпизодов инфекционного респираторного обострения на ранней стадии (т.е. острой фазы), так и путем оценки общего долгосрочного прогресса.
ВЂ™изменение функции легких позволяет понять, достигнут ли контроль заболевания (функциональная стабильность), необходимо ли изменить стратегию лечения (в случае функционального отклонения) и проверить ’эффективность новой персонализированной программы терапии (спирометрическое восстановление или стабилизация). Как видно, правильная оценка легочной функции необходима для эффективной программы лечения и последующего наблюдения, определяющей, по крайней мере, частично и, следовательно, возможность лучшего прогноза у конкретного пациента. По этим причинам необходимо знать возможности и ограничения этого обследования.
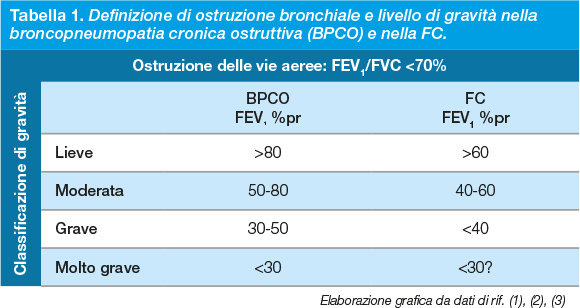
Спирометрическое исследование может быть использовано для диагностики бронхиальной обструкции (функциональный обструктивный дефект, характерный для МВ), определяемой по индексу Тиффено, т.е. отношению форсированного дыхательного объема за первую секунду (FEV1) к форсированной жизненной емкости (FVC), которое составляет менее 70%. В этих условиях степень снижения FEV1 определяет уровень тяжести обструктивного заболевания легких (табл. 1).
Определение бронхиальной обструкции и степени тяжести при хронической обструктивной болезни легких (ХОБЛ) и МВ.
※
FEV 1 является наиболее часто используемым параметром при функциональной оценке пациента с МВ и выражается в процентах от ожидаемого значения с учетом пола, возраста и роста (% пред.), как и другие показатели, измеряемые с помощью спирометрии. Точечное определение значения FEV 1 представляет лишь частичный интерес.
ТамГІ что ГЁ наиболее важно оценить его’прогресс с течением времени и сравнить его с “лучшим” уровнем функции легких субъекта: нормальное значение FEV 1 % pred. не исключает значительного клинического ухудшения, и всегда следует оценивать в этих случаях также потерю объема в абсолютном выражении (мл).
В случаях легкой бронхиальной обструкции значительное снижение FEV 1 в абсолютном выражении может соответствовать незаметной процентной потере. Следует также помнить, что при оценке тяжести заболевания значение FEV 1 должно быть связано с возрастом пациента: например, у 10-летнего ребенка FEV 1 60% пред. означает тяжелое заболевание, у взрослого — нет.
Мы также должны учитывать, что в отношении эволюции повреждения легких бронхиальная обструкция является относительно поздним событием, которое иногда можно измерить только после того, как анатомическое повреждение, обнаруживаемое с помощью визуализации, уже произошло, а функциональное повреждение, безусловно, уже началось. Поэтому нормальная спирометрия не является показателем отсутствия повреждения легких.
Кроме того, на этой стадии заболевания ожидаемая потеря функции легких, характерная для раннего течения МВ, меньше, чем может определить спирометрия. У таких пациентов высокий коэффициент вариации FEV1 и тем более потоков малого объема (которые определяют начальное повреждение мелких дыхательных путей) не позволяют оценить отклонения от ожидаемого функционального снижения примерно на 1-2%/год.
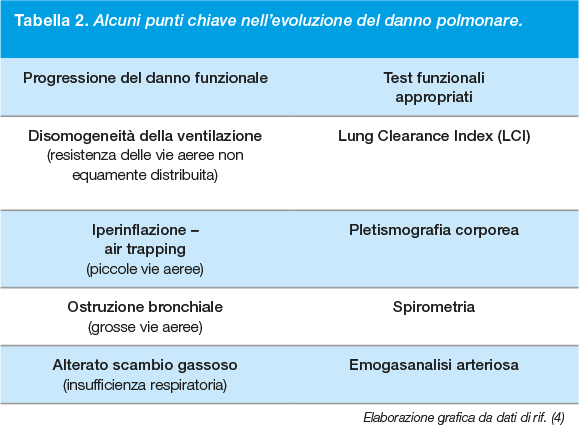
Другие функциональные тесты, такие как плетизмография тела и измерение LCI (индекс просвета легких), могут помочь в этом отношении, поскольку гиперинфляция и вентиляционная неоднородность предшествуют началу бронхиальной обструкции (Таблица 2).
Некоторые ключевые моменты в эволюции повреждения легких.
‒
Если хочется остановиться на спирометрии (более тонкие тесты не всегда доступны) ГЁ следует отметить, что, как уже говорилось, первым признаком нарушения функции легких является снижение форсированного экспираторного потока между 25 и 75% от FVC (FEF 25-75 ), очень изменчивый параметр и поэтому трудно оцениваемый.
На более поздних стадиях заболевания, когда имеется тяжелая бронхиальная обструкция и/или дыхательная недостаточность, легочные объемы и потоки настолько малы, что их изменение крайне ограничено, вплоть до того, что практически не поддается измерению. В этих обстоятельствах спирометрическое исследование может не коррелировать даже со значительными клиническими изменениями.
Проведение анализа газов артериальной крови или мониторинг ’ прогресса насыщения оксигемоглобина может дать гораздо больше полезной информации для оценки ’ прогресса функции легких.
Помимо выявления и мониторинга легочного заболевания МВ, спирометрия также используется для оценки возможной обратимости бронхиальной обструкции, т.е. наличия астмы. Это очень недооцененный момент, несмотря на то, что признано, что многие пациенты с МВ страдают астмой. Функционально астма определяется как обратимая бронходилатация после ингаляции бронхолитика, т.е. после премедикации сальбутамолом 400 мкг, ’увеличение FEV 1 не менее чем на 12% от исходного уровня (или 200 мл) (1).
ВЂ™важность выявления астматического пациента с МВ двояка. С одной стороны, астма может быть проявлением важного (если не преобладающего) легочного воспалительного компонента, который необходимо учитывать в индивидуальной программе лечения, применяя, например, противовоспалительное лечение (местное или системное).
Во-вторых, раздражительность бронхов может стать препятствием для плана лечения, разработанного для пациента, делая его непригодным для введения определенных ингаляционных препаратов и тем самым ограничивая возможность лечения.
Спирометрия в оценке аэрозольных лекарственных средств
Поэтому в клинической практике целесообразно периодически оценивать функциональный ответ на ингаляцию сальбутамола и проводить фармакологический тест перед назначением аэрозольных препаратов (в первую очередь антибиотиков и муколитиков), особенно у пациентов с астмой в анамнезе.
Как проводится тест на наркотики? Пациент проводит базальную спирометрию, после чего исследуемый препарат вводится путем ингаляции (аэрозольный раствор или порошок для ингаляций). Спирометрию повторяют через 15 минут после ингаляции. Снижение FEV 1 более чем на 12% от исходного уровня или не менее чем на 200 мл считается бронходилатацией, вызванной лекарственным средством.
Конечно, для препаратов, для которых все еще показана премедикация бронхолитиками (например, раствором гиперсалициловой кислоты), вызов проводится с помощью ингаляции сальбутамола. При проведении этого теста также важно проверить наличие любых тревожных симптомов, таких как раздражающий кашель, раздражение глотки и т.д., чтобы оценить, могут ли эти симптомы, несмотря на исключение индуцированной бронхиальной обструкции, заставить пациента впоследствии прекратить лечение. Действительно, хотя наличие индуцированной бронхиальной обструкции является противопоказанием к назначению исследуемого препарата, наличие симптомов должно быть правильно оценено.
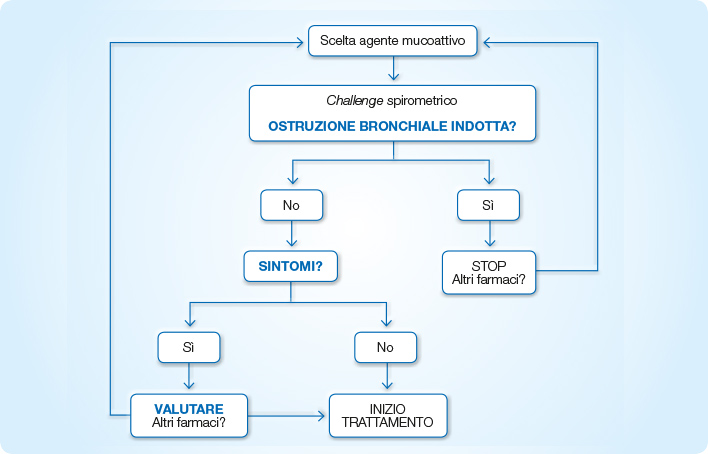
Рациональный подход к безопасному назначению аэрозольного муколитического препарата ГЁ описан на рисунке 1.
Типичным примером является оценка назначения гиперсолевого раствора (NaCl 7%), наиболее широко используемого мукоактивного препарата в лечении МВ, но и одного из наименее переносимых.
Блок-схема для оценки мукоактивных препаратов.
※
ВЂ™эффективность гиперсолевого раствора ГЁ хорошо документирована: улучшенная гидратация бронхиального секрета облегчает мукоцилиарный клиренс и туалет бронхов, позволяя восстановить легочную функцию и уменьшить потребность в антибиотикотерапии (5).
Однако есть, по крайней мере, два барьера, которые ограничивают его’ использование. Во-первых, хорошо документировано, что ингаляция гиперсолевого раствора часто связана с тревожными симптомами, которые заставляют пациентов прекратить лечение (6).
Еще одной проблемой является высокая частота астмы у пациентов с МВ: в нашем недавнем опыте 38% пациентов, получавших гиперсолевой раствор, имели в анамнезе обратимый бронхит (7) и, таким образом, подвергались высокому риску развития лекарственно-индуцированного бронхита.
Несмотря на премедикацию сальбутамолом, индуцированная бронхоконстрикция была зафиксирована у 19% этих пациентов. Для того чтобы уменьшить функциональные и клинические ограничения гиперсолевого раствора, было предложено его’ использование в сочетании с гиалуроновой кислотой.
Гиалуроновая кислота — это полисахарид, состоящий из повторяющихся дисахаридных единиц и являющийся строительным блоком внеклеточного матрикса. Он присутствует во многих органах, включая легкие (в количестве около 150 мг у взрослого человека), где его ПМ составляет около 200 кД. Его физиологические эффекты в легких включают рост и восстановление тканей, барьерный эффект (миграция лейкоцитов и воспалительных ферментов), контроль водного гомеостаза (улучшение эластичности легочных волокон), стабилизацию внеклеточного матрикса, стимуляцию цилиарного ритма и предотвращение повреждения эластина. Представляет интерес терапевтическая роль гиалуроновой кислоты при респираторных заболеваниях (8). Имеется опубликованный опыт лечения хронического бронхита (9) и астмы, вызванной физическими нагрузками (10).
Теоретически, гиалуроновая кислота, добавленная в гиперсолевой раствор, должна была уменьшить соленый вкус, снизить бронхостриктивный эффект (увеличение концентрации NaCl усиливает раздражающее действие на дыхательные пути), сохранив при этом осмотическую силу незащищенного “ гиперсолевого раствора”.
Опыт, накопленный на сегодняшний день, подтвердил, что при М ’ использование гиалуроновой кислоты, добавленной в гиперсолевой раствор, привело к снижению частоты тревожных симптомов (11) и индуцированной бронхоконстрикции (12), наблюдаемых при использовании только гиперсолевого раствора, как у пациентов без бронхов, так и у пациентов с МВ с обратимой бронхиальной обструкцией.
В одном из недавних докладов мы рассказали о нашем опыте лечения группы пациентов с МВ, которым проводился лекарственный вызов с использованием раствора гиперсалина и раствора гиперсалин + гиалуроновая кислота (в дополнение к раствору гиперсалин + маннитол) (7). Во второй группе пациентов (вызов гиперсолевым раствором + гиалуроновая кислота) было большее количество пациентов с обратимой бронхиальной обструкцией (58% против 38% в группе, тестирующей только гиперсолевым раствором), подтвержденной в стабильной фазе заболевания. Это отражает широко распространенную привычку назначать 7% раствор NaCl в первую очередь всем пациентам и, только в качестве альтернативы, раствор гиалуроновой кислоты тем, кто не переносит лечение (что приводит к более высокой частоте непереносимых пациентов в этой группе).
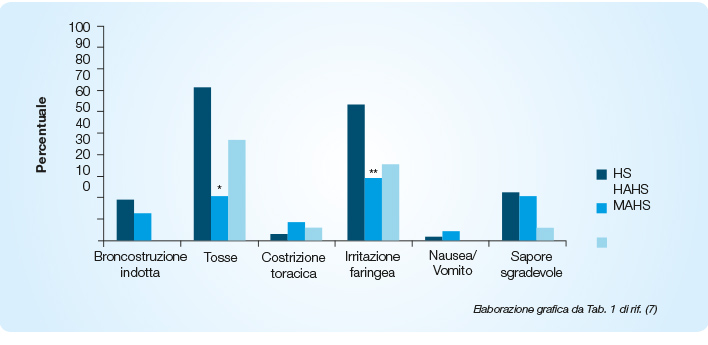
Даже в этих условиях, следовательно, в группе с большим риском индуцированной бронхоконстрикции, раствор гиалуроновой кислоты переносился лучше и вызывал бронхиальную обструкцию реже после ингаляции препарата (12,5%), чем группа пациентов, получавших незащищенный гиперсолевой раствор (19%) (Рисунок 2).
Распространенность индуцированного бронхита и других тревожных симптомов. HS — гиперсалиновый раствор; HAHS — гиперсалиновый раствор + гиалуроновая кислота; MAHS — гиперсалиновый раствор + маннитол. *p=0.008; **p=0.006
※
Оказывает ли гиалуроновая кислота только защитную функцию на дыхательные пути или же она может иметь собственное вспомогательное противовоспалительное действие при МВ, на сегодняшний день не ясно. Данные in vitro и in vivo, подтверждающие противовоспалительный эффект гиалуроновой кислоты, немногочисленны (13). Поэтому нельзя исключать потенциальный противовоспалительный эффект гиалуроновой кислоты (14). Вместо этого он может способствовать всасыванию воды обратно в просвет бронхов, усиливая эффект гиперсолевого раствора, но на сегодняшний день это не подтверждено.
Другие гипотезы могут включать усиление цилиарного ритма, улучшение эластичности легочных волокон, уменьшение повреждения эластина и барьерный эффект (8).
Хотя роль гиалуроновой кислоты в лечении МВ до конца не изучена, ее использование в сочетании с гиперсолевым раствором имеет большое клиническое значение, поскольку позволяет все большему числу пациентов воспользоваться чрезвычайно эффективным мукоактивным лечением, которое в противном случае исключено из-за раздражительности бронхов и частых побочных эффектов.
