- Субъекты
- Абстрактный
- Цель:
- Дизайн:
- Методы:
- Результаты:
- Выводы:
- введение
- методы
- Проектное исследование
- Критерии включения
- Критерии исключения
- Оценки
- Лечение
- статистический анализ
- пациенты
- Клинические и инструментальные характеристики
- результаты
- Рекурренции
- Обсуждение
- Раскрытие информации/конфликт интересов
Видео: Trastorno del espectro de Neuromielitis Óptica (NMO)_Maria Sepúlveda (EM en línea_Oct18) 2021, September
Субъекты
Абстрактный
Цель
Идиопатический поперечный миелит (I-TM) обычно протекает монофазно, тогда как рецидивирующие формы обычно относят к neuromyelitis optica (NMO), атипичному рассеянному склерозу (РС) или миелиту при инфекциях и заболеваниях соединительной ткани. Нашей целью было оценить частоту рецидивирующего И-ТМ; уточнить нозологию этих форм путем сравнения с НМО и постинфекционным ТМ (П-ТМ).
Дизайн:
Проспективное когортное исследование пациентов с И-ТМ было проведено среди пациентов с инфекционными и неврологическими заболеваниями в Италии.
Методы:
В течение 8 лет мы набрали 13 пациентов с I-TM и 16 пациентов с P-TM. Пациенты находились под наблюдением не менее 3 лет с повторными исследованиями магнитно-резонансной томографии головного и спинного мозга (МРТ), мультимодальных вызванных потенциалов и анализа сыворотки крови на соединительную ткань. Рецидивы определялись по клиническим и визуализационным критериям.
результаты:
У четырех пациентов с I-TM (31%) наблюдалось рецидивирующее течение. Все они были мужчинами с возрастом > 50 лет и тяжелой инвалидностью в начале заболевания. Окончательный исход был плохим у трех из четырех пациентов. Сывороточный иммуноглобулин G при НМО был необнаружен у всех пациентов. Продольный обширный миелит не предсказывал рецидив. И-ТМ и П-ТМ имели общие клинические особенности, особенности цереброспинальной жидкости (ЦСЖ) и МРТ, а также сходную частоту (54 против 38%) поражения периферической нервной системы (полирадикулоневрит) и одинаковую частоту рецидивов (31% для обеих форм).
Выводы:
Наши данные подтверждают существование рецидивирующего I-ТМ как заболевания, которое не связано ни с НМО, ни с РС, не может быть уточнено и имеет много общих черт с П-ТМ. Вероятность рецидива была непредсказуемой на основании клинических данных, данных ЦСЖ и МРТ.
Введение
Последние критерии 1 определяют поперечный миелит (ПМ) как развитие в течение трехнедельного периода сенсорной, моторной или вегетативной дисфункции, связанной с поражением спинного мозга, вместе с признаками воспаления спинного мозга по данным спинномозговой жидкости (СМЖ) или магнитно-резонансной томографии (МРТ). В зависимости от результатов широкого инфекционного и аутоиммунного обследования можно выделить две основные группы: идиопатическая МТ и «ассоциированная с болезнью» МТ. Это различие имеет, по сути, прогностические цели. Болезнетворные формы могут иметь рецидивирующее течение, а дифференциальный диагноз включает миелит как первое проявление преимущественно заболеваний центральной нервной системы (ЦНС), таких как нейромиелит (neuromyelitis optica, NMO) и рассеянный склероз (РС), а также связанных с прямыми инфекциями и системными аутоиммунными нарушениями. В отличие от этого, I-TM обычно монофазный. Несмотря на то, что в последних исследованиях, посвященных ТМ, применялась эта схема работы,1 все еще сообщается о единичных случаях или небольших сериях рецидивирующего I-ТМ,2, 3, 4 и их нозология остается спорной. 3, 4, 5, 6 Конечный исход часто характеризуется тяжелой инвалидностью, 3 а возможности лечения для профилактики рецидивов не установлены.
В ходе проспективного расширенного исследования мы ранее оценили течение болезни у пациентов с постинфекционным энцефаломиелитом и миелитом и отметили, что у 25% пациентов наблюдалось рецидивирующее течение; 7 рецидивов ограничились поражением спинного мозга. Затем мы обратили внимание на возникновение рецидивов ТМ среди пациентов с инфекцией вируса гепатита С (ВГС),8 и предложили проводить скрининг на ВГС в каждом случае ТМ. В данном исследовании мы оценили серию I-TM, чтобы оценить частоту рецидивов; затем мы сравнили I-TM с серией постинфекционных TM (P-TM), наблюдавшихся нашей группой в рамках предыдущего исследования7 , чтобы изучить различия между этими формами. Наконец, мы сравниваем монофазный и рецидивирующий, идиопатический или постинфекционный миелит, ищем клинические, ЦСЖ или МРТ-предикторы рецидивирующего течения.
Методы
Дизайн исследования
Мы провели проспективное когортное исследование пациентов, поступивших в неврологические или инфекционные клиники с ТМ за 8-летний период (с 1996 по декабрь 2004 года). Мы исключили пациентов с ТС, связанными с другими заболеваниями ЦНС, предшествующими или непосредственными инфекциями или системными аутоиммунными заболеваниями. Пациенты наблюдались не менее 3 лет. Рецидивы определялись как: (1) внезапное ухудшение неврологического статуса после стабилизации состояния в течение не менее 1 месяца и, (2) новое поражение спинного мозга, выявляемое при МРТ, либо в том же сегменте, что и в первом эпизоде (и, таким образом, видимое как усиление гадолиния), либо на другом уровне (и, таким образом, идентифицируемое как новое гиперинтенсивное поражение T2 с усилением или без усиления в спинном мозге).
Критерий включения
Поперечный миелит был диагностирован на основании: (1) развитие двусторонней сенсомоторной дисфункции, не обязательно симметричной, с четко определенным верхним сенсорным уровнем, с дисфункцией сфинктера или без нее; (2) повреждение гематоэнцефалического барьера, выражающееся в увеличении соотношения ЦСЖ и сывороточного альбумина, 9 или плеоцитозе; (3) гиперинтенсивные поражения Т2 в спинном мозге с усилением или без него. Неврологический синдром должен был развиться менее чем за 3 недели, без предшествующей инфекции или вакцинации в течение предшествующих 4 недель.
Критерии исключения
Мы исключили компрессионные, сосудистые и постлучевые миелопатии; РС (предшествующие неврологические признаки или симптомы, демиелинизирующие поражения мозга на МРТ при включении или во время наблюдения; аномальные зрительные вызванные потенциалы (ЗВП)/мозжечковые слуховые вызванные потенциалы (ССВП)); НМО (аномальный неврит зрительного нерва или ЗВП); системные аутоиммунные заболевания и саркоидоз; инфекционные заболевания.
Скрининг на аутоиммунные заболевания и инфекции 7 был описан и, вкратце, включал определение в сыворотке антинуклеарных, двухцепочечных ДНК, анти-SSA / SSB, антинейтрофильных цитоплазматических, антикардиолипиновых и волчаночных антикоагулянтных антител; уровня ангиотензин-превращающего фермента в сыворотке / CSF; культуры CSF. Титры антител к вирусу Эпштейна-Барр ( EBV), вирусу иммунодефицита человека 1/-2, HCV, Borrelia burgdorferi, Mycoplasma pneumoniae; выявление в сыворотке / ЦСЖ методом ПЦР вируса простого герпеса (HSV) -1 / -2, энтеровируса, EBV, цитомегаловируса, вируса ветряной оспы, HHV-6, HHV-7, HHV-8, гриппа A и B, HCV. Пациенты с сывороточной гиперэозинофилией также были исключены.
оценки
Клинический дефицит оценивался по 10-балльной шкале неврологической оценки Скриппса (SNRS) в момент максимального неврологического дефицита и каждые 2 недели после лечения до достижения стабилизированного неврологического улучшения.
Антитела к нейромиелиту зрительного нерва — иммуноглобулину G (IgG) — искали у всех пациентов на образцах сыворотки, собранных в соответствии с опубликованным протоколом. 11 В нашей лаборатории для диагностики болезни Девика тесты NMO-IgG показали чувствительность 58% и специфичность 100%.
Сывороточный С-реактивный белок (CRP) использовался для измерения системного воспаления. Исследование ЦСЖ включало подсчет клеток, содержание IgG и альбумина, концентрацию глюкозы, соотношение альбумина ЦСЖ и сыворотки 9 и индекс IgG. ЦСЖ и сыворотки были проверены на наличие олигоклональных полос IgG (OB) с помощью изоэлектрического фокусирования агарозы (pH 3, 0-10, 0) и аффинного иммуноблотинга.
МРТ проводилась до проведения спинномозговой пункции с использованием 1, 5 Т Philips Intera. Регистрировались количество, продольная длина, расположение поражения и усиление.
Нейрофизиологическая оценка (ЗВП, медианный/тибиальный соматосенсорный вызванный потенциал (SSEP), BAEP, исследования нервной проводимости) описана в предыдущем отчете, 7 наряду с критериями полирадикулоневрита. 12
Зрительные вызванные потенциалы, SSEP, МРТ головного и спинного мозга повторялись каждые 6 месяцев в течение 3-летнего наблюдения и незамедлительно при рецидивах. В случаях рецидива также проводилось повторное исследование ЦСЖ и скрининг сыворотки и ЦСЖ на аутоиммунные нарушения и инфекции.
Лечение
Пациентов лечили 6-метилпреднизолоном (6-МП) 500-1000 мг ежедневно (до максимальной общей дозы 6 г) как препаратом первого выбора и внутривенным Ig (IVIg), когда стероиды были неэффективны. Неэффективность лечения определялась как улучшение менее чем на 30 баллов SNSR или конечная оценка или 2 = 6,17, P = 0, 046). У двух пациентов с I-TM поражение высокого шейного отдела распространилось на низкий продолговатый мозг.
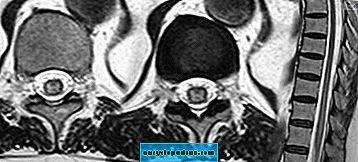
Аксиальные и сагиттальные Т2-взвешенные изображения пациента с идиопатическим поперечным миелитом (ПМ) и полирадикулоневритом. Фузиформное гиперинтенсивное поражение простирается от Т9 до L1, с легким отеком конуса. Поражение в основном затрагивает серое вещество спинного мозга, как передние, так и задние рога.
Полноразмерное изображение
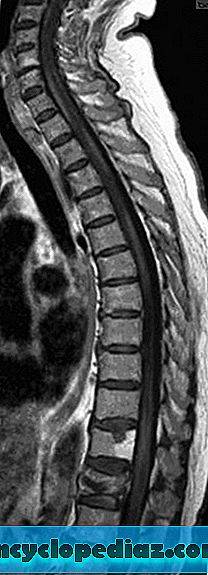
Сагиттальные Т1-взвешенные изображения после введения гадолиния пациента с постинфекционным поперечным миелитом (ПМ), ассоциированным с полирадикулоневритом. На снимке видны множественные мультисегментарные, шейные и грудные поражения, с отеком шейного канатика и конуса. В контрастном усилении также участвуют хвост и конус.
Полноразмерное изображение
С одинаковой частотой наблюдалось поражение периферической нервной системы (ПНС) (7 из 13 пациентов, 54%, при И-ТМ, 5 из 16 пациентов, 38%, при П-ТМ), с преимущественно аксональным повреждением у 4 из 7 пациентов.
результаты
Рецидивы
Из 13 пациентов у 4 был рецидив I-TM (31%): все они были мужчинами старше 50 лет (табл. 1). Общий период наблюдения составил от 38 месяцев до 8 лет. У всех пациентов был один рецидив, который возник через 3-11 месяцев после первого эпизода, с вовлечением того же сегмента позвоночника, что и первый эпизод. У трех из четырех пациентов был тяжелый исход. Рецидивы лечили стероидами (три пациента) или IVIg (один пациент с резистентностью к стероидам). Метотрексат 10 мг в неделю (один пациент), циклофосфамид внутривенно 20 мг/кг -1 в месяц (один пациент), не предотвратили прогрессирование двигательной дисфункции.
Полноразмерная таблица
Среди П-ТМ рецидив возник у 5 из 16 пациентов (31%) (Таблица 2), три женщины и двое мужчин, возраст 24-71 год. Рецидивы происходили без каких-либо видимых предшественников, за исключением одного пациента, у которого рецидив произошел через 3 недели после вакцинации против гриппа. Время до первого рецидива составило 5-14 месяцев. Множественные рецидивы наблюдались у четырех из пяти пациентов. После 1-3 рецидивов три пациента начали пероральный прием азатиоприна 2 мг/кг/день (четыре пациента) или циклофосфамида (два пациента) в соответствии с дозами, указанными выше, что не предотвратило дальнейших рецидивов или прогрессирующего ухудшения. Только у одной пациентки, у которой после введения азатиоприна произошел рецидив, назначение циклофосфамида оказалось эффективным для предотвращения дальнейшего ухудшения: после 5 лет наблюдения и четырех эпизодов миелита у нее уже 3 года нет рецидивов, и она по-прежнему может ходить без поддержки.
Полноразмерная таблица
Сравнение монофазной и рецидивирующей форм представлено в таблицах 2 и 3 и на рисунке 3.
Полноразмерная таблица
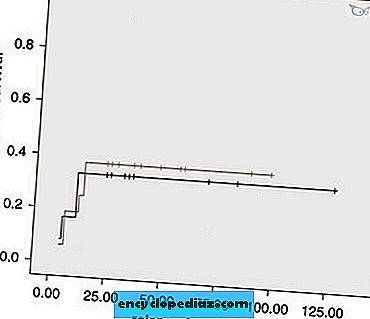
Оценка безрецидивной выживаемости по модели Кокса при постинфекционном (серая линия) и идиопатическом (черная линия) поперечном миелите. Существенной разницы в течении заболевания между двумя группами не было (χ 2 = 0, 007, P = 0, 93).
Полноразмерное изображение
Обсуждение
В нашей серии мы обнаружили рецидив I-TM в 4 из 13 случаев (31%), со следующими характеристиками: (1) мужской пол; (2) возраст > 50 лет; (3) тяжелая моторная дисфункция и дисфункция сфинктера; (4) отрицательный OB, нормальный индекс IgG и отрицательный NMO-IgG.
Консенсусные критерии для ТМ 1 не были доступны на момент решения этого проспективного исследования. По сравнению с ними, наши критерии отбора также включают 3-летнее наблюдение, в дополнение к исключению пациентов с аномальными ЗВП и HCV-инфекцией. Действительно, недавние сообщения, классифицированные как НМО, относятся к рецидивирующему миелиту с аномальными ЗВП, 5, 6 в то время как другие сообщения идентифицируются как инфекция ВГС в ассоциации с рецидивирующим миелитом. 8, 13
Если мы ретроспективно применим критерии, установленные рабочей группой консорциума TM, к нашим пациентам, мы сможем определить наших пациентов как определенных на основе клинических характеристик, характеристик ЦСЖ и МРТ спинного мозга. Что касается недавно предложенного различия между «частичным» и «полным» миелитом, 14 наши пациенты с выраженной двигательной и сфинктерной дисфункцией и хорошо выраженным сенсорным уровнем относятся к группе «полного», а не частичного острого миелита: это различие направлено на дальнейшее отделение форм с вероятностью рецидива от тех, которые практически не рецидивируют. Фактически, в нашей серии только у двух пациентов (2 из 21: 7%), которые соответствовали критериям включения, развился РС во время наблюдения. Несмотря на более строгие критерии отбора 1 и включение форм с тяжелыми двигательными нарушениями, было установлено, что 30% случаев «идиопатического» ТС имеют рецидивирующее течение, вне контекста РС, васкулита, НМО, заболевания соединительной ткани и инфекции. О рецидивах I-TM сообщается в единичных сообщениях и в небольших сериях: 2, 3, 4, 5 интерпретации указывают на ограниченные формы НМО, 5, 6 с возможным субклиническим вовлечением зрительного нерва, выявляемым только с помощью ЗВП или специфического заболевания. 3 Что касается НМО, у наших пациентов также наблюдалось тяжелое неврологическое поражение с выраженной двигательной и сфинктерной дисфункцией; плеоцитоз ЦСЖ; повреждение кровеносного барьера; нормальный индекс IgG; отсутствие или преходящее ОБ; на МРТ — выраженное поражение серого вещества, с ЛЭТМ в 54%. У двух пациентов поражение распространялось на ствол мозга, что описано в серии случаев НМО. Однако мы считаем, что рецидивирующий I-TM у наших пациентов отличался от ограниченных форм НМО по следующим причинам: В отличие от НМО, у наших пациентов не наблюдалось поражения зрительного нерва ни клинически, ни субклинически; на МРТ не было выявлено Т1-ипоинтенсивных поражений и масс-эффектов в острой фазе, а также ковитации и участков атрофии спинного мозга во время наблюдения; Несмотря на частое возникновение ЛЭТМ, у 46% пациентов были моносегментарные, возможно, мультифокальные поражения, что необычно для НМО; наконец, NMO-IgG отсутствовали у всех пациентов.
Напротив, мы обнаружили, что I-ТМ имеет много общих клинических, ЦСЖ и МРТ признаков с П-ТМ. Вовлечение ПНС, осложнение, редко наблюдаемое при миелите, кроме постинфекционного миелита, было выявлено в 54% случаев И-ТМ и в 30% случаев «истинного» П-ТМ. Особенности поражения ПНС в виде полирадикулоневрита, в отличие от синдрома Гийена-Барре, были схожи с теми, которые наблюдались при П-ТМ: отсутствие цитологическо-альбуминовой диссоциации; выраженное аксональное повреждение. Вовлечение нервных корешков, рентгенологический аналог полирадикулита, было заметно в 19% случаев (рис. 2). По сравнению с П-ТМ мы обнаружили лишь незначительные тенденции различий: распространенность среди женщин; более низкое начало заболевания и более высокая инвалидизация после лечения; менее явные признаки воспаления ЦСЖ; менее обширные поражения на сагиттальных сканах и менее распространенное поражение шейного отдела. Эти две формы также имели одинаковый процент неэффективности стероидов. Что касается характеристик рецидивов, единственным отличием была тенденция к множественным рецидивам в П-ТМ, хотя мы наблюдали один рецидив среди И-ТМ. При обеих формах рецидив обычно возникал в том же сегменте, который был поражен первым эпизодом (за одним исключением в обеих группах), и без какой-либо распознаваемой предшествующей инфекции (за исключением вакцинации против гриппа у пациента с П-ТМ).
Постинфекционные ТМ, даже классически рассматриваемые как монофазные, 1 не подпадают под критерии Рабочей группы по ТМ. Некоторые авторы классифицируют эти формы как варианты острого диссеминированного энцефаломиелита (ADEM),15 но общего мнения по поводу этой классификации нет. Возможность рецидивов, которые обычно ограничиваются поражением спинного мозга, теперь рассматривается как осложнение ADEM. 16 Является ли наличие или отсутствие предшествующей инфекции единственным реальным различием между этими двумя формами, неизвестно. Сравнивая П-ТМ и И-ТМ, мы не нашли реальных причин для разделения этих сущностей. Также была обнаружена одинаковая частота рецидивов, что усиливает сходство между этими двумя формами. По крайней мере, в исследованиях, касающихся методов лечения и прогноза, серии случаев миелита должны включать как постинфекционные, так и идиопатические случаи. Учитывая эти сходства, мы решили сравнить монофазные и рецидивирующие формы в обеих группах (П-ТМ и И-ТМ), и четких различий не выявили, с ограничениями, представленными низким количеством рецидивов по сравнению с монофазными случаями (9 против 20). Рецидивы почти всегда связаны с плохими исходами, а предикторы рецидивов и эффективные варианты лечения для профилактики рецидивов до сих пор не установлены.
Раскрытие информации/конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
